Основой ПЦР является повторяющиеся циклы in-vitro синтеза определенного участка ДНК, приводящие к геометрическому росту (амплификации) количества копий этого участка ДНК в растворе. В результате каждого цикла амплификации происходит удвоение количества копий ДНК (ампликонов) в растворе, а повторение цикла амплификации приводит к увеличению количества молекул ДНК в геометрической прогрессии.
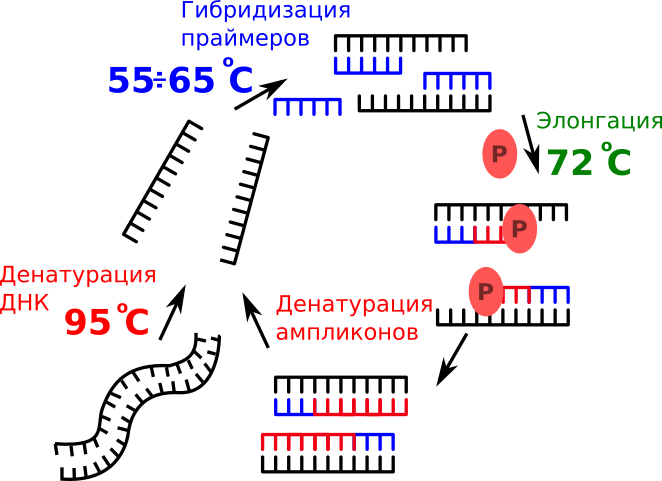
Механизм амплификации ДНК
Удвоение происходит в результате ферментативного синтеза комплементарной нити ДНК в условиях циклического изменения температуры реакционной смеси в соответствии с температурно-временным режимом амплификации. Изменением температуры проводится управление тремя физико-химическими процессами в растворе (Рисунок 1):
- При температуре 95ºC проходит диссоциация двухцепочечных молекул ДНК с образованием двух отдельных нитей ДНК, стадия денатрурации;
- При охлаждении раствора до 55÷65°C к одноцепочечным молекулам ДНК присоединеняются олигонуклеотиды (праймеры) и ДНК-полимераза, стадия гибридизации;
- При температуре 72ºC происходит синтез комплементарной нуклеотидной последовательности, стадия элонгации.

Cтадии гибридизации и элонгации сложно разделить и они часто объединяются в одну. Оптимальная температура гибридизации зависит от нуклеотидной последовательности праймеров, а ДНК-полимеразы имеют довольно широкие температурные границы активности. Поэтому на практике, особенно в ПЦР в режиме реально времени, где амплифицируются короткие участки ДНК, используют термоцилирование между температурами 95°C и 60÷65°C. К тому же это позволяет экономить время, которое тратится на нагрев и охлаждение растворов.
Состав раствора для ПЦР
Состав реакционной смеси для проведения ПЦР может сильно варьироваться в зависимости от природы и качества выделенной ДНК, природы и свойств фермента, нуклеотидной последовательности праймеров и принципов детектирования ампликонов. Стандартная реакционная смесь содержит целевую или контрольную ДНК, пару коротких олигонуклеотидов (праймеров), смесь трифосфатов дезоксирибонуклеотидов, термостабильную ДНК-полимеразу, ионы магния и компоненты буферной системы (Трис-HCl).
Приблизительный качественный и количественный состав ПЦР-смеси приведен в таблице:
| Компонент | Содержание | Роль |
| Целевая ДНК | 10 фг ÷ 10 мг | Выполняет роль матрицы для синтеза |
| Праймеры | 0,1÷1,0 мкМ | Ограничивают и определяют амплифицируемый участок ДНК, являются затравкой для синтеза |
| ДНК-полимераза | 0,2÷2,0 единицы | Фермент, осуществляющей синтез комплементарной последовательности |
| Ионы магния (Mg2+) | 0,5÷5,0 мМ | Кофермент ДНК-полимеразы |
| Дезоксирибонуклеозидтрифосфаты (dATP, dGTP, dCTP, dTTP) | по 200 мкМ | Используются для синтеза комплементарной последовательности |
| Буферный раствор | pH=8.3, 50мМ KCl | Создание ионной силы раствора и pH |
Кроме указанных компонентов, ПЦР-смесь может содержать:
- Флуоресцентные зонды или интеркалирующие красители, которые позволяют проводить детектирование ампликонов;
- Контрольную ДНК, в случае использования мультиплексной ПЦР амплификация контрольного участка ДНК позволяет выявить ложноотрицательные результаты;
- Желатин или бычий сывороточный альбумин, позволяют снизить или нивилировать влияние ингибиторов в анализируемом образце (часто содержатся в буфере, посталяемом с ДНК-полимеразой);
- Неионногенные детергенты (Triton-X100, Tween-80, DMSO), помогают провести денатурацию исходной ДНК.
Компоненты ПЦР-смеси можно разделить на две группы, специфические и неспецифические. Это дает возможность проводить смешение компонентов в несколько этапов для удобства работы и снижения трудозатрат. Сначала смешиваются неспецифические реактивы (вода, буфер, раствор ионов магния, ДНК-полимераза и т.д), затем эта смесь разливается по пробиркам и в нее добавляются специфические реактивы (праймеры и зонды). Далее в пробирки добавляется анализируемый образец.
