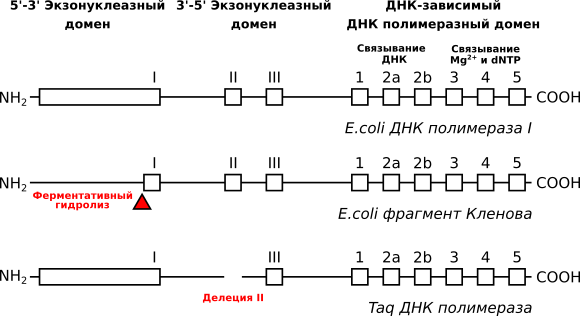
Первоначально в полимеразной цепной реакции использовался фрагмент Кленова [1], который является продуктом ферментативного гидролиза ДНК-полимеразы I, выделенной из кишечной палочки. ДНК-полимераза является ключевым элементом ПЦР и ее характистики в значительной степени связаны с характеристиками ПЦР-анализа. Поиск новых и модификация существующих ДНК-полимераз велись в основном в двух направлениях: повышение температурной стабильности и возможность температурной активации фермента. Эти характеристики значительно упрощают анализ, снижают вероятность контаминации лаборатории и повышают селективность анализа. Модификация ДНК-полимераз для устойчивости к ингибиторам востребована для прямого анализа проб, например, крови.
Taq ДНК-полимераза
Проведение ПЦР включает в себя обязательную стадию денатурации синтезированных нитей ДНК при температуре 95°C, но при такой температуре происходит деактивация фермента и требуется добавление свежей порции. Проведение 30-40 циклов уже требует значительных затрат времени, фермента и внимания исследователя. К тому же при таком количестве манипуляций возрастает риск контаминации реактивов продуктами реакции. Таким образом, существовала острая практическая необходимость в ДНК-полимеразе, которая сохраняет активность при высокой температуре.
В 1976г. Трела выделил термостабильную ДНК-полимеразу из бактерии Thermophilus aquaticus, живущей в горячих термальных источниках при температуре 70-75°C [2]. ДНК-полимераза (Taq-полимераза), выделенная из этой бактерии, имела схожее строение с ДНК-полимеразой I кишечной палочки, за исключением того, что она не имела фрагмента, отвечающего за 3’-5’-эконуклеазную активность. Taq-полимераза не так быстро инактивировалась при нагреве, как фрагмент Кленова, но потребовалось несколько лет, чтобы реализовать ПЦР с термостабильным ферментом [3]. Использование термостабильной полимеразы позволило провести необходимое количество циклов ПЦР в закрытой пробирке без добавления свежего фермента. Это резко подняло интерес к практическому применению ПЦР.
По сравнению с фрагментом Кленова, Taq-полимераза имеет ряд преимуществ [4]:
- При температуре 95°C сохраняется 50% активности в течении 40 мин, при температуре 92,5°C — 130 мин, 97,5°C — 5-6 мин. Это значит, что после 50 циклов с денатураций 20 с при температуре 95°C, ещё остаётся 50% активности;
- Во время проведения ПЦР не требуется добавление свежих порций фермента, что значительно снижает трудоёмкость и вероятность контаминации реактивов и лаборатории;
- Высокая оптимальная температура синтеза позволяет снизить неспецифическую гибридизацию праймеров и образование вторичной и четвертичной структуры ДНК, которая затрудняет гибридизацию и синтез комплементарной последовательности;
- Отсутствие фрагмента, отвечающего за 3’-5’-эконуклеазную активность приводит к большей скорости синтеза комплементарной последовательности, по сравнению с фрагментом Кленова;
- Taq-полимераза способна синтезировать фрагменты ДНК длиной до 4000 п.о., в то время как при использовании фрагмента Кленова длина нуклеотидной последовательности ограничена 400 п.о.
- Итоговая концентрация ампликонов при использовании Taq-полимеразы примерно в 10 раз выше, чем при использовании фрагмента Кленова;
- При синтезе Taq-полимераза добавляет аденозин к тупым концам двойной цепочки амплифицируемого участка, что может быть использовано для дальнейшего клонирования.
Модификация Taq ДНК-полимеразы
Повышенный интерес к ПЦР и Taq-полимеразе привел к двум модификациям:
- Для коммерческих целей Taq-полимеразу выделяли из генетически-модифицированных культур кишечной палочки. Это позволило не только снизить стоимость и увеличить количество получаемого фермента. В выделенном ферменте отсутствовали термостабильные нуклеазы, которые вызывали гидролиз исходной ДНК и синтезированных ампликонов;
- Появились ферменты (ДНК-полимеразы с «горячим стартом»), активность которых появляется только после термературного нагрева, обычно 5-10 мин при 95°С. Такая модификация позволяет предотвратить неспецифическую амплификацию, проходящую в процессе приготовления смеси и при первоначальном нагреве. Модификация фермента может проводиться несколькими способами:
- генетическая модификация ДНК-полимеразы, в результате которой фермент сворачивается в неактивную форму, а при нагреве трансформируется в активную. Примерами таких ферментов являются Thermo-start [5], Proofstart [6] и FastStart;
- добавление в смесь ингибитора активности, который связывается с активным сайтом ДНК-полимеразы, но при нагреве диссоциирует. Температура диссоциации должна быть ниже, температуры при которой проводится стадия элонгации. Такой механизм используется в HS TaQuant-OFF [7];
- добавление в смесь антитела, который связывается с активным сайтом ДНК-полимеразы, а при нагреве происходит денатурация антитела и его диссоциация [8]. Такой механизм наиболее распространён и используется в ферментах Taq Platinum, JumpStart.
Применение Taq-полимеразы, конечно, не решило всех проблем. Исследователями продолжается поиск новых ферментов для снижения количества неспецифических продуктов, увеличения точности синтеза и длины синтезируемого участка. Так же востребованы ферменты, которые позволяют проводить анализ сложных образцов (цельной крови или её фракций, биологических образцов, образцов окружающей среды) без выделения ДНК.
ДНК-полимеразы устойчивые к ингибиторам
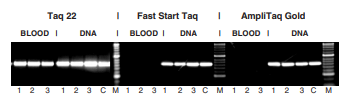
Чувствительность метода ПЦР позволяет анализировать образцы без конценрирования и даже с разбавлением. Однако наличие ингибиторов в пробе требует выделения и очистки ДНК. Так как одной из мишеней ингибиторов является ДНК-полимераза [9], то ее модификация позволяет создать устойчивые к ингибировованию ферменты и проводить прямой анализ проб. Серия N-концевых мутаций позволяют добиться значительной устойчивости к ингибиторам, включая цельную кровь, плазму, гемоглобин, лактоферрин, сывороточный IgG, экстракты почвы и гуминовую кислоту, а также высокие концентрации интеркалирующих красителей.
Литература
- K. Mullis, F. Faloona, S. Scharf, R. Saiki, G. Horn, H. Erlich / Specific Enzymatic Amplification of DNA In Vitro: The Polymerase Chain Reaction // Cold Spring Harbor Symposia on Quantitative Biology, Cold Spring Harbor Laboratory, 1986
- A. Chien, D. Edgar, J. Trela / Deoxyribonucleic asid polymerase from the extreme thermophile Thermus aquatics // Journal of Bacteriology, 1976, 127(3), 1550-1957
- R. Saiki, D. Gelfand, S. Stoffel, S. Scharf, R. Higuchi, G. Horn, K. Mullis, H. Erlich / Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase // Science, 1988, 239, 487-491
- E. Pelt-Verkuil, A. Belkum, J Hays / Principles and Technical Aspects of PCR Amplification // Springer, 2008
- Thermo Scientific Thermo-Start Taq DNA Polymerase
- ProofStart™PCR Handbook
- New products for molecular biology // Molecular Biotechnology, 1999, 11(1), 109–111
- D. Kellogg, I. Rybalkin, S. Chen, N. Mukhamedova, T. Vlasik, P. Siebert, A. Chenchik / TaqStart Antibody: "hot start" PCR facilitated by a neutralizing monoclonal antibody directed against Taq DNA polymerase // BioTechniques, 1994, 16(6), 1134-1137
- M. Kermekchiev, L. Kirilova, E. Vail, W. Barnes / Mutants of Taq DNA polymerase resistant to PCR inhibitors allow DNA amplification from whole blood and crude soil samples // Nucleic Acids Research, 2009, 37 (5), 40
